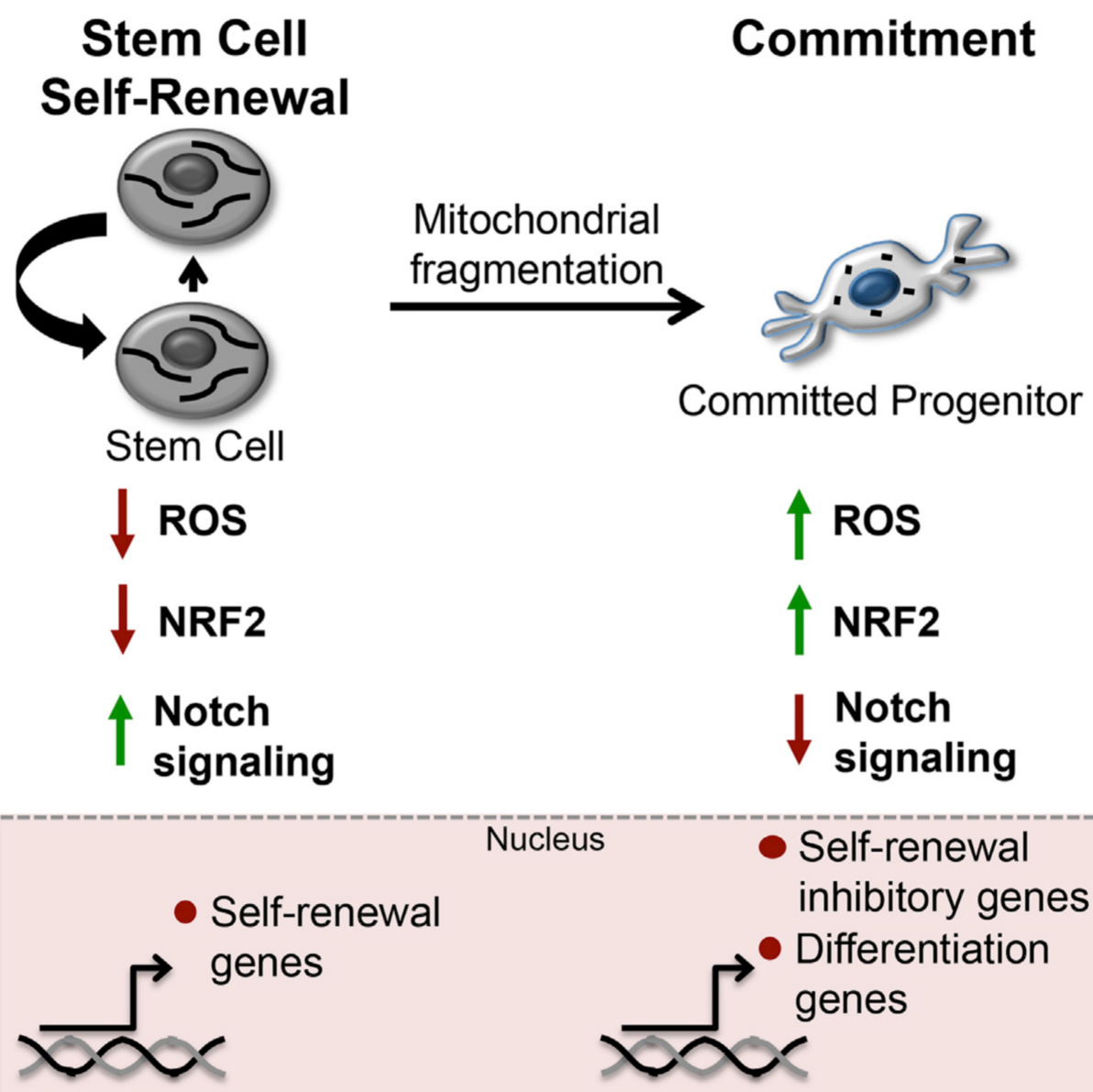
干细胞的自我更新及分化对于组织稳态平衡及再生修复至关重要。一旦该平衡被打破会引起一系列的疾病,如近年来研究表明干细胞数量的减少与衰老及退行性疾病密切相关。因此,深入了解干细胞自我更新及分化的调控机制是防止干细胞耗竭和衰老的关键所在。虽然线粒体的动态变化在组织发育和稳态维持的过程中发挥基础作用,但是干细胞的线粒体究竟如何对干细胞产生影响至今未得到深入了解。来自加拿大渥太华大学的Khacho等研究人员针对上述问题进行了深入探索,发现线粒体本身的动态变化能够调控干细胞的特性、自我更新以及命运决定,这种调控作用是通过协调一系列基因的转录编程而实现的。
研究人员发现通过敲除线粒体融合蛋白MFN1/2或者OPA1会引起干细胞中严重的线粒体碎片化,由此损伤神经干细胞的自我更新的自我更新能力,直接导致神经元生成障碍以及认知能力下降。随后研究人员进行了基因表达谱分析进一步探讨其内在分子机制,结果显示在此过程中Notch信号途径的抑制分子Botch并促进未成熟细胞启动分化程序,而这一过程是由ROS调控NRF2所引起的。该发现表明线粒体动力学是影响干细胞自我更新和命运决定过程的上游调控因素,并且这种调控是通过转录编程完成的。这项研究为深入理解干细胞损伤导致的疾病机制以及干细胞治疗的开发应用提供了重要的理论依据。