心肌梗塞(Myocardial Infarction)是当下全球人口中最大的死因之一。目前,临床上尚无手段弥补心梗造成的心肌细胞减少。已有一些试验性研究,但却因为种种挑战仍与临床医学应用有着相当的距离。
将干细胞悬液施于梗塞部位以使其分化为心肌细胞是一种看似最为直观的方法。然而,这些游离的单个细胞很难留存于梗塞部位,绝大多数在几天内便会“逃逸”进入血液循环。若将干细胞包裹在水凝胶的多孔小型组织支架中再植入梗塞部位,虽然留存情况会改善,但由于支架中氧气扩散的速率往往难以满足干细胞的需要,后者在这些支架中会大量死亡。更为令人担忧的是,分化程度较低的干细胞可能会在心肌内形成肿瘤。为了避免这一后果,上述干细胞通常需要经过一定程度的分化,以减少发生癌变的几率;然而分化的时机需精确掌控。只有让干细胞成为处于早期分化阶段的心肌细胞,再进行植入,才能既减少癌变风险,又使其被周围的受体心肌细胞调试,发展出与其一致的电生理特性。
近期,俄亥俄州立大学的研究团队摸索出了一套有效的干细胞疗法,在心肌梗塞小鼠模型中取得了显著的效果,该方法模仿了早期胚胎发育的过程。研究人员先将小鼠胚胎干细胞植入海藻酸盐水凝胶外壳包裹的微囊内,这里的水凝胶外壳类似于早期胚胎的透明带。干细胞会首先分裂,形成由干细胞组成的细胞聚集体,进入到了类似于桑椹胚的阶段。之后,研究人员通过引入BMP-4和bFGF等诱导因子将微囊中的干细胞团初步诱导为处于早期分化阶段的心肌细胞,再将上述初步分化的细胞团通过先后浸泡于壳聚糖和氧化海藻酸盐的溶液中,被包裹进入海藻酸盐-壳聚糖(ACM)微型水凝胶中,以备心肌植入。
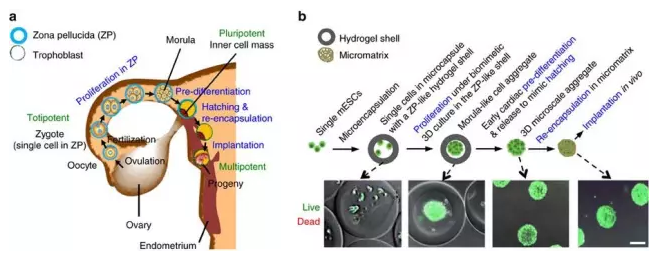
处分化心肌细胞团制作步骤(b)与胚胎发育过程(a)对照
研究人员通过左前降支动脉的永久性结扎,制备小鼠心肌梗塞模型,并在5分钟后,将包裹有初步分化心肌细胞的ACM微囊植入小鼠的心肌梗塞部位。小鼠的心肌功能(例如射血分数、心输出量、每搏输出量等指标)在这之后出现了显著改善,且发生纤维化的比例下降。此外,这些植入的初分化细胞经过继续分裂和分化,已于周围的受体心肌细胞融为了一体,并且没有发生癌变。
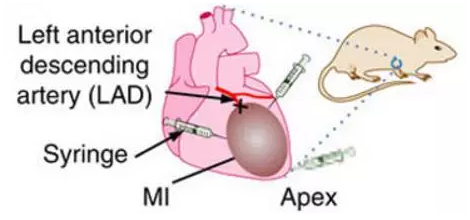
小鼠心肌梗塞手术和疗法操作示意
由胚胎发育过程启发而设计出的心肌梗塞干细胞疗法不仅显著恢复了小鼠模型的心肌功能,还有效地避免了受体免疫反应和癌变等风险。水凝胶微囊不仅提高了植入细胞的留存度和存活率,而且创造了一个局部性的保护性微环境,使其免受免疫攻击,并在“安全护送”植入细胞后可自行降解。这一手段为心肌梗塞干细胞疗法的开发提供了宝贵的思路。
NATURE COMMUNICATIONS, DOI: 10.1038/ncomms13306