焦虑症(anxiety disorder)是全球患病率最高的一种心理障碍,它会使患者陷入模糊的恐惧、莫名其妙的紧张和担忧中。焦虑会激活交感神经系统进而调控神经内分泌系统,常伴有出汗、心率加快、促肾上腺皮质激素释放因子(CRF)和糖皮质激素水平升高等特征(图1)【1, 2】。
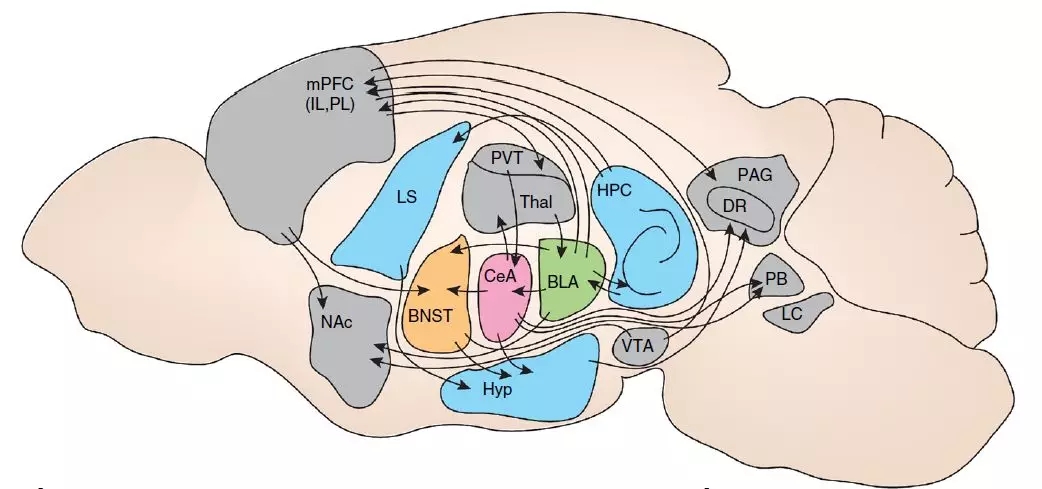
图1 焦虑行为相关的神经环路
已有研究表明褐色脂肪和白色脂肪组织均受交感神经支配。焦虑能持续使交感神经兴奋,分泌神经递质去甲肾上腺素,从而激活褐色脂肪的产热功能;同时动员白色脂肪的脂解功能,为褐色脂肪产热提供燃料,这有可能降低肥胖发生的风险(图2)【3, 4】。而高水平的糖皮质激素可导致向心性肥胖如库欣综合征(Cushing syndrome)【5】。但是,目前焦虑与能量代谢的调控关系还不清楚。
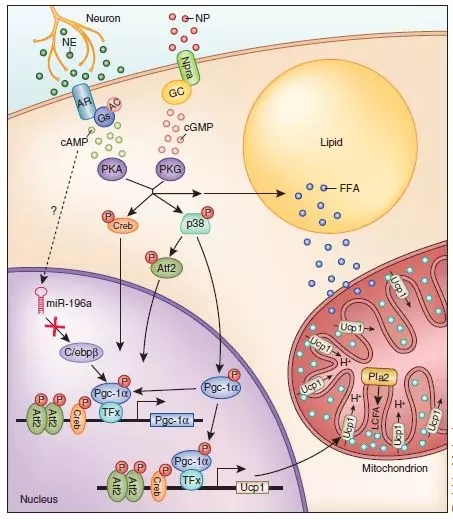
图2 去甲肾上腺素诱导脂肪细胞产热
近日,来自美国Scripps Research Institute的Baoji Xu课题组在Cell Metabolism上发表题为Activation of Anxiogenic Circuits Instigates Resistance to Diet-Induced Obesity via Increased Energy Expenditure的研究论文,揭示了焦虑神经环路与能量代谢的因果关系,即杏仁核基底外侧核群(BLA) 的BDNF通过调控GABA的合成来影响交感神经的兴奋程度,进而调控机体的基础代谢率、白色脂肪棕色化和棕色脂肪的产热。
脑源性神经营养因子BDNF (brain-derived neurotrophic factor)可以影响GABA递质的传递和突触的可塑性,其缺失会导致认知障碍、焦虑和富有攻击性等表型【6, 7】。为了研究下丘脑外BDNF对能量代谢的调控,研究人员首先构建了Emx1Cre/+ ;Bdnflox/lox小鼠,发现该小鼠的皮层、海马和杏仁核部分亚区如基底外侧核群(basolateral amygdala, BLA)的Bdnf基因均能被特异敲除。与全脑或全身Bdnf敲除小鼠的肥胖表型不同,该小鼠的表现为食量更大、体重与对照组比没什么显著差异。造成这一结果是因为该小鼠能通过白色脂肪棕色化和能量消耗的增加来减少脂肪的含量。
接着,研究人员又用高脂饲料来喂养Emx1Cre/+ ;Bdnflox/lox小鼠【8】,发现它们的体重明显比野生型低、糖耐量和胰岛素敏感性也显著改善,说明该小鼠能抵抗高脂饮食诱导而产生的肥胖表型。Bdnf敲除小鼠皮下脂肪(iWAT)酪氨酸羟化酶(tyrosine hydroxylase,合成交感神经递质去甲肾上腺素的限速酶)和肾上腺素能受体(ADRB3,脂肪细胞去甲肾上腺素的主要受体)表达升高,激活了肾上腺素能受体的信号通路,进而激活脂肪酶(pHSL,脂解的关键酶)以分解更多的脂肪来产热。综上,交感神经活性的增强能促进皮下脂肪的脂解和棕色化,同时也增强了棕色脂肪(iBAT)的适应性产热,从而改善了小鼠的代谢状况。
我们知道焦虑、富有攻击性等应激行为均会增加能量的消耗。为了研究Bdnf敲除小鼠攻击性表型对代谢是否有影响,研究人员构建了只有攻击性表型的Bdnflox/lox;KA1-Cre小鼠(海马CA3区特异敲除),排除了攻击性表型对脂肪含量的影响,从而明确了是该能量代谢是由焦虑神经环路调控的。那小鼠焦虑表型是如何产生的呢,有报道表明BDNF-TrkB(tyrosine kinase receptor B,酪氨酸激酶受体B)信号通路与焦虑症的发生密切相关【9】。研究发现BDNF-TrkB信号通路的缺失会降低谷氨酸脱羧酶(GAD65,突触前膜合成GABA的关键酶)的含量,从而减少了GABA递质(抑制性神经递质)的释放,由此产生了焦虑的表型。
那么是哪个脑区调控着脂肪组织的能量代谢呢?由于Emx1Cre/+ ;Bdnflox/lox小鼠的皮层、海马和杏仁核等区域的BDNF敲除了。为了鉴定哪个区域的神经元,作者采用了跨突触病毒标记的方法来研究这个问题,研究发现真正起调控作用的神经元位于基底外侧核群(BLA)。特异性敲除杏仁核中BDNF基因能诱导出小鼠焦虑的表型,野生型小鼠使用GABA受体的反相激动剂(与受体结合后可引起受体的构型向非激活状态方向转变)后它们的能量消耗增加。在突变小鼠的杏仁核中重新表达BDNF蛋白时,它们焦虑和代谢的表型均好转。这些结果表明激活小鼠焦虑神经环路可以促使交感神经的兴奋,通过提高脂肪组织的适应性产热和基础代谢率来增加能量的消耗,进而降低了体重(图3)。
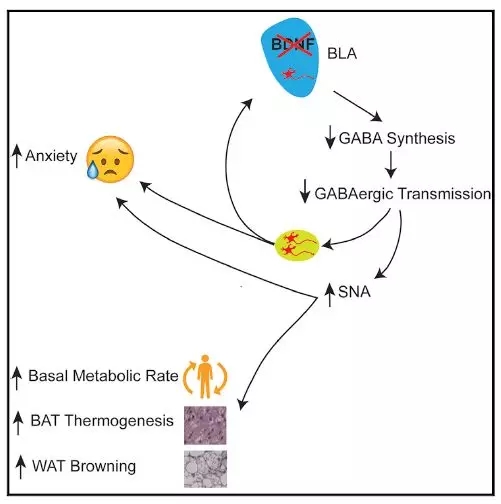
图3 焦虑神经环路调控能量代谢
总而言之,本项研究发现杏仁核的BDNF通过调空神经递质GABA的传递来影响情绪,最重要的是揭示了焦虑神经环路与能量代谢的因果关系,这为焦虑症药物的开发奠定了基础。
值得一提的是,该工作发表之后,Nature Reviews Endocrinology杂志对该工作进行了highlight。
原文链接:
https://www.cell.com/cell-metabolism/fulltext/S1550-4131(18)30755-1
制版人:珂
1. Calhoon GG, Tye KM: Resolving the Neural Circuits of Anxiety. NAT NEUROSCI 2015, 18,1394-1404.
2. Kreibig SD: Autonomic Nervous System Activity in Emotion: A Review. BIOL PSYCHOL 2010, 84,394-421.
3. Bachman ES, Dhillon H, Zhang CY, Cinti S, Bianco AC, Kobilka BK, Lowell BB: BetaAR Signaling Required for Diet-Induced Thermogenesis and Obesity Resistance. SCIENCE 2002, 297,843-845.
4. Harms M, Seale P: Brown and Beige Fat: Development, Function and Therapeutic Potential. NAT MED2013, 19,1252-1263.
5. Charmandari E, Tsigos C, Chrousos G: Endocrinology of the Stress Response. ANNU REV PHYSIOL2005, 67,259-284.
6. Huang EJ, Reichardt LF: Neurotrophins: Roles in Neuronal Development and Function. ANNU REV NEUROSCI 2001, 24,677-736.
7. Park H, Poo MM: Neurotrophin Regulation of Neural Circuit Development and Function. NAT REV NEUROSCI 2013, 14,7-23.
8. Gorski JA, Talley T, Qiu M, Puelles L, Rubenstein JL, Jones KR: Cortical Excitatory Neurons and Glia, but Not GABAergic Neurons, are Produced in the Emx1-expressing Lineage. J NEUROSCI 2002, 22,6309-6314.
9. Mohler H: The GABA System in Anxiety and Depression and its Therapeutic Potential.NEUROPHARMACOLOGY 2012, 62,42-53.