心血管疾病已成为全世界范围内威胁人类健康的头号杀手,在各类心血管疾病中,又以动脉粥样硬化的危害最为严重。动脉粥样硬化是一种慢性炎症疾病,其中低密度脂蛋白和巨噬细胞的作用尤为重要。动脉粥样硬化发生最为关键的触发因素是富含载脂蛋白ApoB的脂蛋白在内皮下沉积激活内皮细胞,募集血液中的单核细胞向动脉的内皮下浸润并分化为巨噬细胞,进而摄取沉积于动脉壁的修饰后脂蛋白形成泡沫细胞引发一系列的炎症反应。
近日, 来自军事科学院军事医学研究院生命组学研究所/国家蛋白质科学中心(北京)的张令强团队首次报道酪蛋白激酶2相互作用蛋白1(casein kinase 2-interacting protein-1, CKIP-1)在动脉粥样硬化过程中的保护性作用及分子机制。相关研究成果以CKIP-1 limits foam cell formation and inhibits atherosclerosis by promoting degradation of Oct-1 by REGγ 为题发表于Nature Communications 杂志。
CKIP-1最初作为CK2激酶的结合蛋白而被发现,张令强团队对此分子开展了近20年的深入研究,先后阐明了其在调控骨发育与骨质疏松症、心脏发育与心肌肥大、肿瘤发生发展等过程中的重要作用【1-3】。
在这项研究中,研究人员首先发现CKIP-1在心脏泡沫细胞形成过程中被显著诱导表达,提示其可能参与泡沫细胞的调控,进一步的研究揭示CKIP-1抑制巨噬细胞对氧化低密度脂蛋白的摄取进而抑制泡沫细胞的形成。结合生物信息学分析和体内外生化实验,研究人员发现CKIP-1特异下调脂蛋白摄取过程中发挥重要作用的清道夫受体LOX-1的表达,但不影响清道夫受体CD36和SR-A的表达。机制研究表明,CKIP-1通过偶联蛋白酶体激活因子REGγ促进对LOX-1上游转录因子Oct-1的降解,从而抑制LOX-1的转录,通过此机制,CKIP-1抑制泡沫细胞的形成。在高脂诱导的动脉粥样硬化小鼠模型中,敲除CKIP-1可显著促进动脉斑块的形成并增加斑块的不稳定性和炎症反应,并通过骨髓移植构建嵌合鼠模型验证CKIP-1缺陷引发的动脉粥样硬化过程加重主要依赖于骨髓细胞的效应。因此,CKIP-1是动脉粥样硬化发生早期应激响应的关键分子,它的上调对机体发挥了保护性作用。
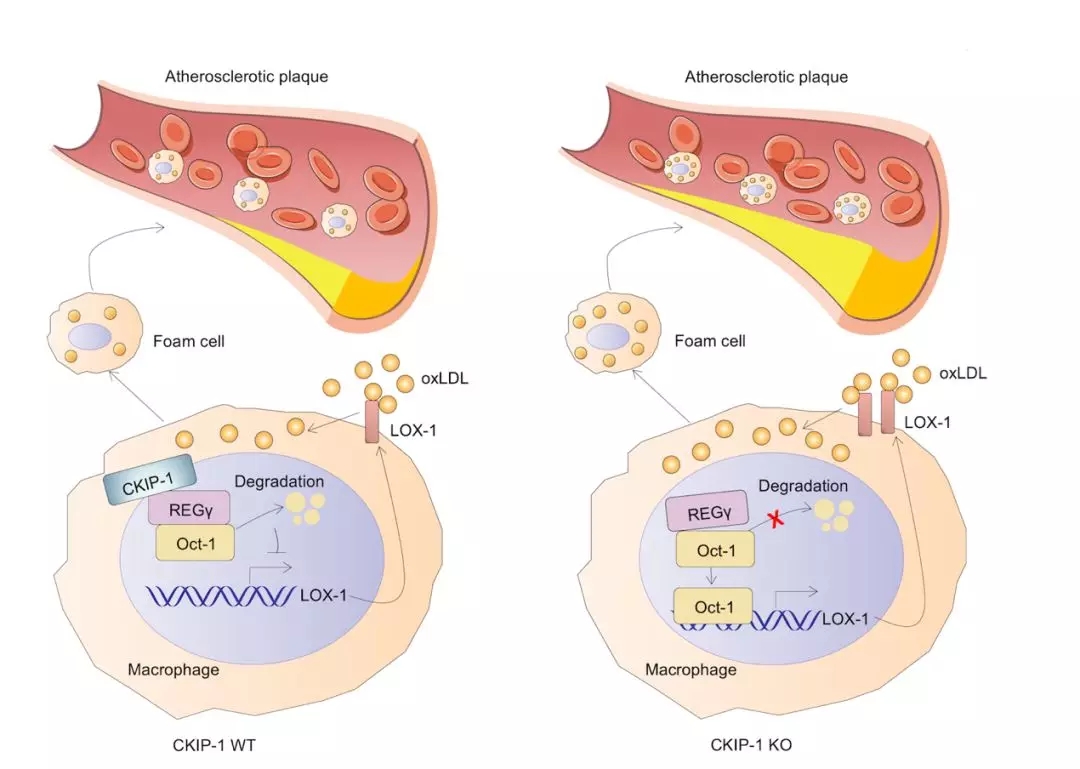
总的来说,该研究发现了CKIP-1在调控巨噬细胞功能和动脉粥样硬化过程发挥重要生物学功能,并揭示了清道夫受体LOX-1及其转录因子Oct-1新的调节机制,有助于加深对动脉粥样硬化发生机理的认识,为探索动脉粥样硬化过程防治新思路提供了科学依据。
参考文献:
1、Lu, K. et al. Targeting WW domains linker of HECT-type ubiquitin ligase Smurf1 for activation by CKIP-1. Nat. Cell Biol. 10, 994–1002 (2008).
2、Ling, S. et al. CKIP-1 inhibits cardiac hypertrophy by regulating class II histone deacetylase phosphorylation through recruiting PP2A. Circulation 126, 3028–3040 (2012).
3、Zhang, L. et al. CKIP-1 regulates macrophage proliferation by inhibiting TRAF6-mediated Akt activation. Cell Res. 24, 742–761 (2014).