记忆 T细胞是一种“记仇”的细胞,能够长期识别出那些以前遇到的特定微生物。当病原体再次侵犯时,能够很快作出反应。这也是疫苗出现的基础,通过人工减毒的病原体来激活记忆T细胞。因此,了解如何建立和维持免疫记忆可以为改进疫苗的设计提供参考。
但记忆T细胞的来源一直以来并不明确,直到最近Nature上的两篇论文提出,记忆T细胞是来自于效应T细胞,从而揭示了记忆T细胞的起源。
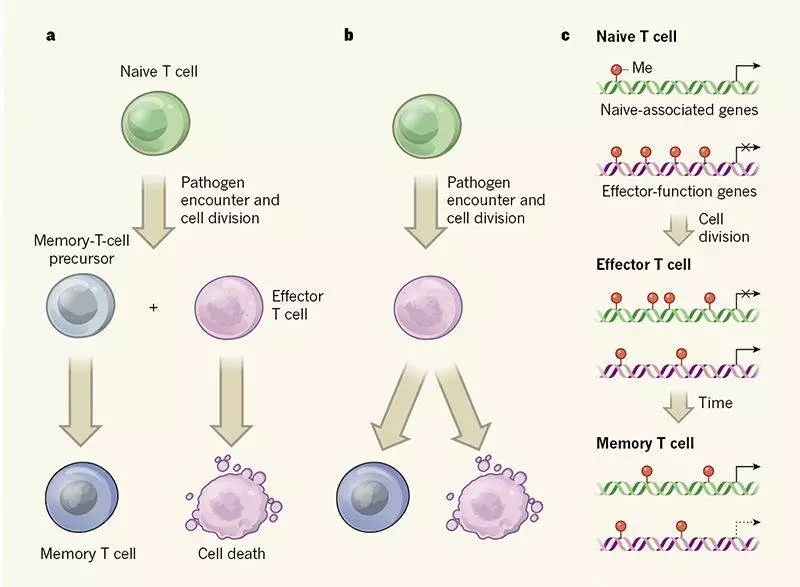
记忆T细胞在对病原体做出反应之前,被称为初始T细胞(Naive T cell, Tn)。当它们识别出病原体时,它们迅速分裂并表达诸如有助于抵抗感染的细胞因子蛋白质这样的分子。这些反应细胞被称为效应T细胞,更具体的说,是一种称为细胞毒性T细胞的效应细胞,它们可以进到炎症组织中并杀死感染的细胞。
一旦病原体被消除,大多数效应细胞就会死亡,但是仍然存在一小部分长寿命记忆细胞,如果再次发生感染,那么它们就会迅速作出反应,这些长寿的细胞就是记忆T细胞。
关于记忆T细胞的起源,目前提出两种可能:一种认为记忆T细胞是直接从初始T细胞中产生,这种细胞可能早在其第一次细胞分裂时就会产生具有效应T细胞或记忆T细胞潜能的细胞;另一种则认为,记忆T细胞是从逃逸死亡的效应细胞中产生的。
Akondy团队和Youngblood团队近期在Nature发表的论文就是为了搞清这个过程。
Effector CD8 T cells dedifferentiate into long-lived memory cells.
Origin and differentiation of human memory CD8 T cells after vaccination.
他们向DNA中插入甲基团(Me)来监测,这种改变通常与基因表达的降低有关。之后分析了初始T细胞、效应T细胞和记忆T细胞中与初始细胞功能和效应细胞功能相关基因的甲基化情况,以揭示细胞的发育历程。
这两项新的研究都是通过追踪感染过程中的CD8 + T细胞来解决这一争论。所不同的是,Akondy 等人研究了接受黄热病病毒疫苗的人,而Youngblood和他的同事们选择了淋巴细胞性脉络丛脑膜炎病毒感染的小鼠模型。
这两项研究都检测了天然,效应和记忆T细胞表观遗传修饰的群体中可遗传的化学修饰或对不改变DNA序列的细胞DNA的结构变化。这种变化往往与基因表达调控有关,使细胞及其后代能够“标记”一种特定的基因表达模式。DNA甲基化就是这样一种改变,可以将基因固定在“off”位,从而使其表达沉默。
Akondy团队检查了T细胞中的DNA构型,确定“Close”状态的基因组区域,基因表达机制无法访问基因组区域,而处于“Open”状态的区域允许基因表达。虽然RNA分析能够得到当前细胞转录基因的快照,但作者还是用了分析表观遗传变化的方法来寻找到达转录状态的具体路径。
Youngblood团队做了全基因组的DNA甲基化分析发现,作者发现DNA甲基转移酶Dnmt3a是在免疫反应期间负责从头DNA甲基化的关键酶。在初始T细胞分化为效应T细胞后,其DNA甲基化谱发生改变。许多与初始状态相关的基因被加上了甲基,而在编码效应物应答的关键基因处发现了甲基的消失。在分化成记忆T细胞的效应T细胞中,初始状态下的基因甲基化会在这个过程中被去除。
两项研究得出的结论是,虽然记忆T细胞不再表达效应分子,但编码这些分子的基因仍然是处于低甲基化状态。所以即便这些记忆T细胞不分裂或表达效应分子,但在遇到病原体时就会再活化分裂出效应T细胞。效应T细胞产生高水平的颗粒酶B和穿孔素,即发挥它们的免疫作用的功能分子。在记忆T细胞并不含有颗粒酶B和穿孔素,但是它们也没有完全关闭这些基因。
他们证实了,记忆CD8 T细胞起源自一小部分效应CD8 T细胞。不过记忆T细胞中也是存在差别的,一部分像初始T细胞那样在整个身体内循环,等待着免疫系统的召唤;另一部分则是驻留在诸如肺、皮肤和肠组织中,这些组织都是抵抗病原体第一道防线。这些不同类型的记忆T细胞是否通过相同的途径产生仍有待确定。