炎性小体(Inflammasomes)是先天免疫防御的重要哨兵,感知病原体并诱导受感染细胞死亡。炎性小体传感器能检测和响应特定的病原体或损伤相关的分子模式(分别称为 PAMP 或 DAMP),在感染过程中,病原体可以诱导多种PAMPs和DAMPs的释放,从而激活多个炎性小体传感器以响应疾病【1, 2】。已知AIM2 炎性小体可感知双链DNA,但AIM2的几个关键功能已经超出其在炎性小体形成和细胞焦亡中的典型作用(Nature | “欲生欲死”——AIM2炎症小体同时促进巨噬细胞增殖和焦亡导致动脉粥样硬化;Nature | AIM2炎症小体通过监控DNA损伤来影响神经系统发育)。单纯疱疹病毒1 (Herpes simplex virus 1, HSV1) 作为一种双链DNA病毒可导致终生无法治愈的复发性病变,Francisella是一种革兰氏阴性菌可在感染后迅速致死,这两种不同的病原体均可激活AIM2【3, 4】,但导致细胞死亡的分子机制还不清楚。
近日,来自美国圣裘德儿童研究医院的Thirumala-Devi Kanneganti团队在Nature杂志上发表了一篇题为 AIM2 forms a complex with pyrin and ZBP1 to drive PANoptosis and host defence 的文章,这项研究提出AIM2调节先天免疫传感器pyrin和ZBP1以驱动炎症信号传导,以及一种独特的细胞死亡类型——细胞广泛凋亡(PANoptosis),在HSV1和Francisella感染期间发挥宿主保护作用。

首先,该团队利用HSV1或F. novicida感染了野生型骨髓源性巨噬细胞(bone marrow-derived macrophages, BMDMs)和几个主要炎性小体传感器单独缺失的BMDMs。相对于野生型而言,Mefv(编码pyrin)–/– BMDMs 中的炎症小体激活和细胞死亡部分减少,进一步的筛选发现在感染和无菌条件下负责调节炎症细胞死亡的传感器ZBP1的缺失也会导致炎症信号产生和细胞死亡减少,提示pyrin和ZBP1在这一过程中的重要性。为了确认pyrin和ZBP1两者间的作用方式,作者使用秋水仙素抑制Zbp1–/– BMDMs中的pyrin激活,结果提示两者为协同作用而非冗余,而生成的Mefv–/– Zbp1–/–小鼠中的BMDMs均比单独缺失的BMDMs中炎症信号和细胞死亡程度弱,也进一步肯定了上述结论。这些结果表明,在这两种感染期间,pyrin和ZBP1协同诱导AIM2所介导的炎症信号传导和细胞死亡反应。
最近有研究表明程序性细胞死亡途径之间存在广泛的串扰,并建立了PANoptosis的概念【5】。上述发现提示HSV1和F. novicida可以激活多个炎性体传感器,同时也激活了参与细胞焦亡、凋亡和坏死性凋亡途径的关键分子。然而,这些关键分子在感染后的Mefv–/–和Zbp1–/–BMDMs中表达降低,而在Aim2–/–或Mefv–/–Zbp1–/–BMDMs种完全丧失,提示HSV1和F. novicida感染以依赖于AIM2、pyrin和ZBP1的协同激活方式来诱导PANoptosis。考虑到AIM2的缺失完全消除了炎症细胞死亡,而pyrin或ZBP1缺失仅导致部分减少,且AIM2的缺失会导致pyrin和ZBP1的表达降低,表明AIM2在pyrin和ZBP1上游起作用。
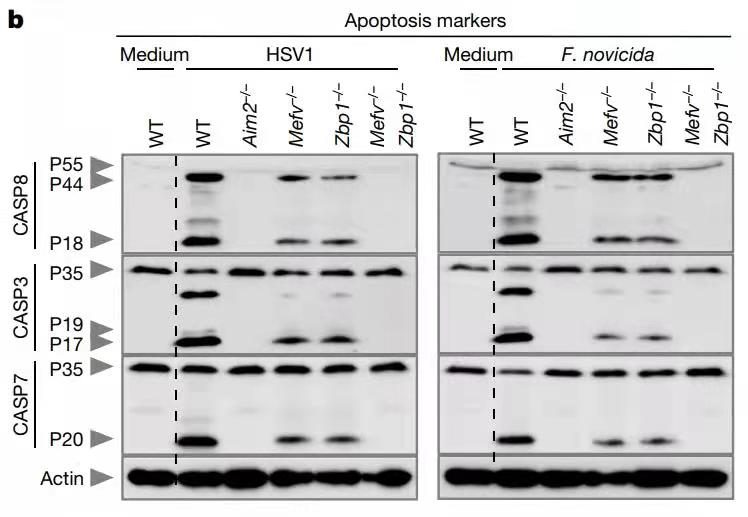
图1. 以细胞凋亡关键分子为例展示在HSV1和F. novicida感染时,AIM2、pyrin和ZBP1对于诱导PANoptosis的重要性(细胞焦亡和坏死性凋亡途径结果类似)
基于上述结果,作者猜想这些分子可能作为一个分子支架的组成部分,能同时募集参与细胞焦亡、细胞凋亡和坏死性凋亡的关键蛋白质。为了验证这个想法,作者通过免疫沉淀实验观察到在HSV1和F. novicida感染后ASC与AIM2、pyrin、ZBP1、caspase-1、caspase-8、RIPK3、RIPK1和FADD的相互作用,而AIM2炎性小体配体poly(dA:dT)的处理则会导致与pyrin、ZBP1、caspase-8、RIPK3、RIPK1 或 FADD等的作用丧失,提示一种多蛋白细胞死亡诱导复合物的存在,作者称之为“AIM2 PANoptosome”。
接下来,作者建立了HSV1和F. novicida感染的小鼠模型,肺组织裂解物显示出关键的细胞焦亡、凋亡和坏死性凋亡分子的激活以及pyrin和ZBP1的表达增加,而在Aim2–/–小鼠中未发现上述现象。此外,所有缺乏AIM2的小鼠都在8天内死于HSV1 感染,而缺乏pyrin或ZBP1的小鼠在13天内死亡,野生型小鼠有70%的存活率,而F. novicida感染小鼠也有类似结局。这些结果强调了AIM2通过调节pyrin和ZBP1表达和PANoptosis在宿主抵御HSV1和F. novicida感染中的重要作用。
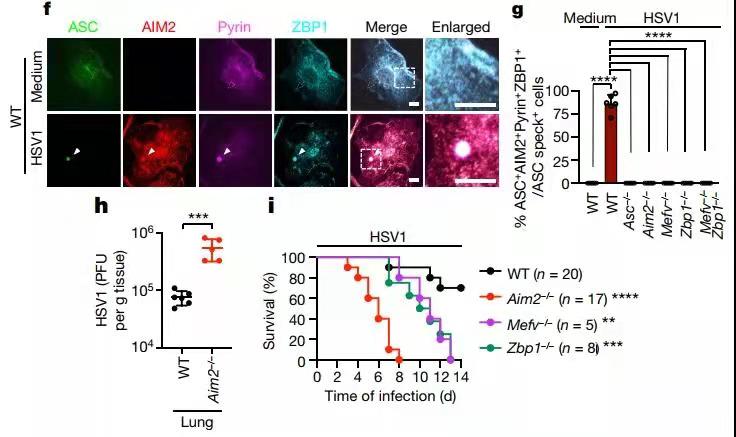

图2. HSV1感染后,ASC+AIM2+pyrin+ZBP1+在细胞内的共定位,以及不同小鼠模型的存活率
总的来说,这项工作确定了先前未知的AIM2、pyrin和ZBP1之间的关键相互作用,即通过形成AIM2 PANoptosome的多蛋白复合物以在HSV1和F. novicida感染期间诱导PANoptosis,从而增强宿主防御。同时,也促进了这些分子在先天免疫和炎性细胞死亡中的功能理解,并为相关疾病提出了新的治疗靶点。
原文链接:https://doi.org/10.1038/s41586-021-03875-8
参考文献:
1. Man, S. M., Karki, R. & Kanneganti, T. D. Molecular mechanisms and functions of pyroptosis, inflammatory caspases and inflammasomes in infectious diseases. Immunol. Rev. 277, 61–75 (2017).
2. Karki, R. et al. Concerted activation of the AIM2 and NLRP3 inflammasomes orchestrates host protection against Aspergillus infection. Cell Host Microbe 17, 357–368 (2015).
3. Man, S. M. et al. The transcription factor IRF1 and guanylate-binding proteins target activation of the AIM2 inflammasome by Francisella infection. Nat. Immunol. 16, 467 475 (2015).
4. Rathinam, V. A. et al. The AIM2 inflammasome is essential for host defense against cytosolic bacteria and DNA viruses. Nat. Immunol. 11, 395–402 (2010).
5. Malireddi, R. K. S. et al. Innate immune priming in the absence of TAK1 drives RIPK1 kinase activity-independent pyroptosis, apoptosis, necroptosis, and inflammatory disease. J. Exp. Med. 217, e20191644 (2020).