近年来,利用外泌体作为靶向药物投递载体受到越来越多的关注。但是现有来源的外泌体存在安全性低和难以规模化生产等问题,其临床转化存在困难。近日,我院亓洪昭博士在《Theranostics》上发表论文,报道利用pH响应分离法获取血液TfR+外泌体用于肿瘤靶向药物投递,该研究有利于实现外泌体作为纳米药物载体的临床转化。
表面含转铁蛋白受体的外泌体(TfR+外泌体)在动物血液中含量丰富,同时具有高的生物安全性,其作为纳米药物载体具有良好的临床转化潜力。然后现有外泌体分离方法很难实现血液TfR+外泌体的精准、高效分离,成为限制血液TfR+外泌体研究的瓶颈。

在此项研究中,研究人员充分利用了转铁蛋白(Tf)和转铁蛋白受体(TfR)结合的pH响应特性(机制如图1)。在pH 7.4条件下,饱和转铁蛋白(holo-Tf)可结合TfR;将pH由7.4调整为5.0,此时holo-Tf释放铁离子形成脱铁转铁蛋白(apo-Tf),但是apo-Tf仍与TfR保持结合状态;再次将pH由5.0调整为7.4,此时apo-Tf才与TfR分离。
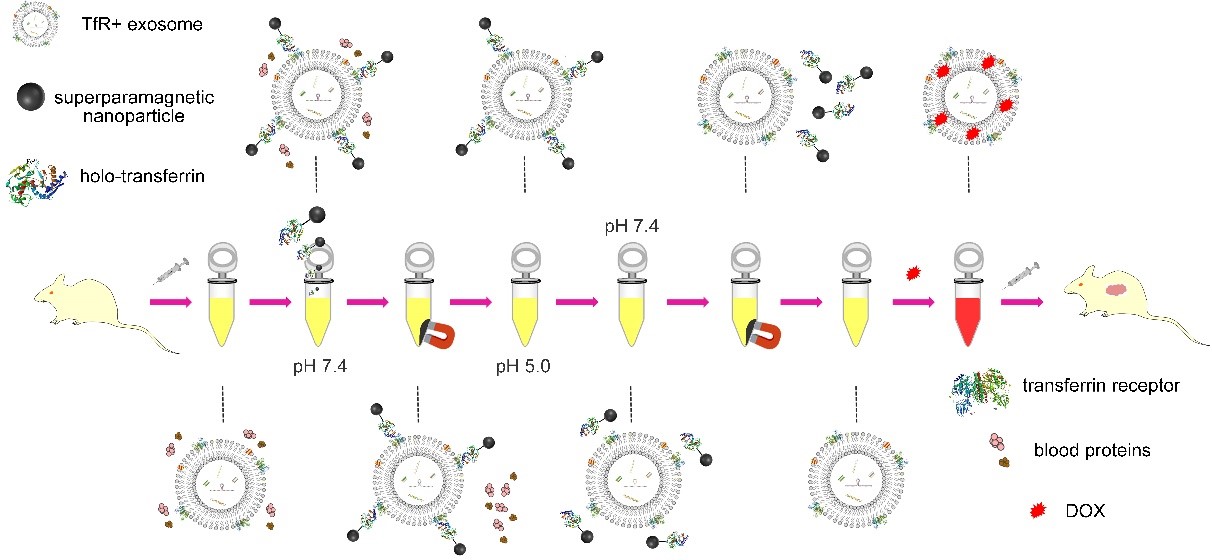
图1. Tf与TfR结合的pH响应性。
基于这一特性,研究人员将超顺磁纳米粒子(SPMNs)与holo-Tf连接,利用Tf与TfR的特异性结合,实现SPMNs与血液TfR+外泌体的结合,形成基于外泌体的超顺磁纳米团簇体系。在外加磁场作用下,该体系可实现快速磁分离,同时利用Tf与TfR结合的pH响应性可将SPMNs从血液TfR+外泌体表面脱离,从而实现血液TfR+外泌体的精准、高效分离。所获血液TfR+外泌体可高效介导化疗药物阿霉素的肿瘤靶向治疗。研究示意图如图2。
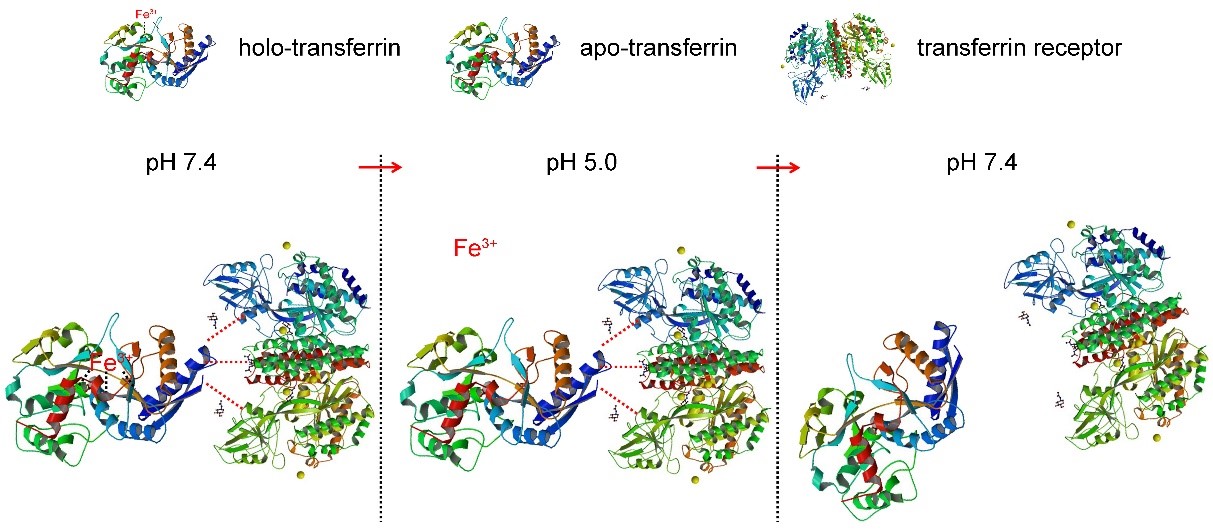
图2. 研究示意图。
参考文献:
Yang L, Han D, Zhan Q, Li X, Shan P, Hu Y, Ding H, Wang Y, Zhang L, Zhang Y, Xue S, Zhao J, Hou X, Wang Y, Li P, Yuan X, Qi H. Blood TfR+ exosomes separated by a pH-responsive method deliver chemotherapeutics for tumor therapy. Theranostics 2019; 9(25):7680-7696. doi:10.7150/thno.37220.
原文链接:http://www.thno.org/v09p7680.htm