近期华侨大学陈爱政教授和哈佛医学院Y. Shrike Zhang教授合作采用微流控技术并优化工艺参数制备出大多孔高分子微球以及中空短棒状微纤维,分别作为成肌细胞和内皮细胞的微载体,共培养后获得微球状肌肉微组织和纤维状血管微组织,以期体外构建可注射型血管化的肌肉微组织,更好地模拟体内细胞-细胞以及细胞-环境间的相互作用及血管化肌组织特有的微环境,从而用于肌组织原位再生的研究。
首先,该工作利用微流控技术制备了PLGA大多孔微球(PLGA PMs)并体外构建微组织(图1)。在PLGA PMs中接种C2C12,通过动态培养法探索细胞组织聚集体的形成条件及肌肉微组织的形成过程,构建3D肌肉微组织模型。结果发现,在共培养7天后,分散性良好的微球之间开始聚集,并在后续培养过程中形成组织团块。
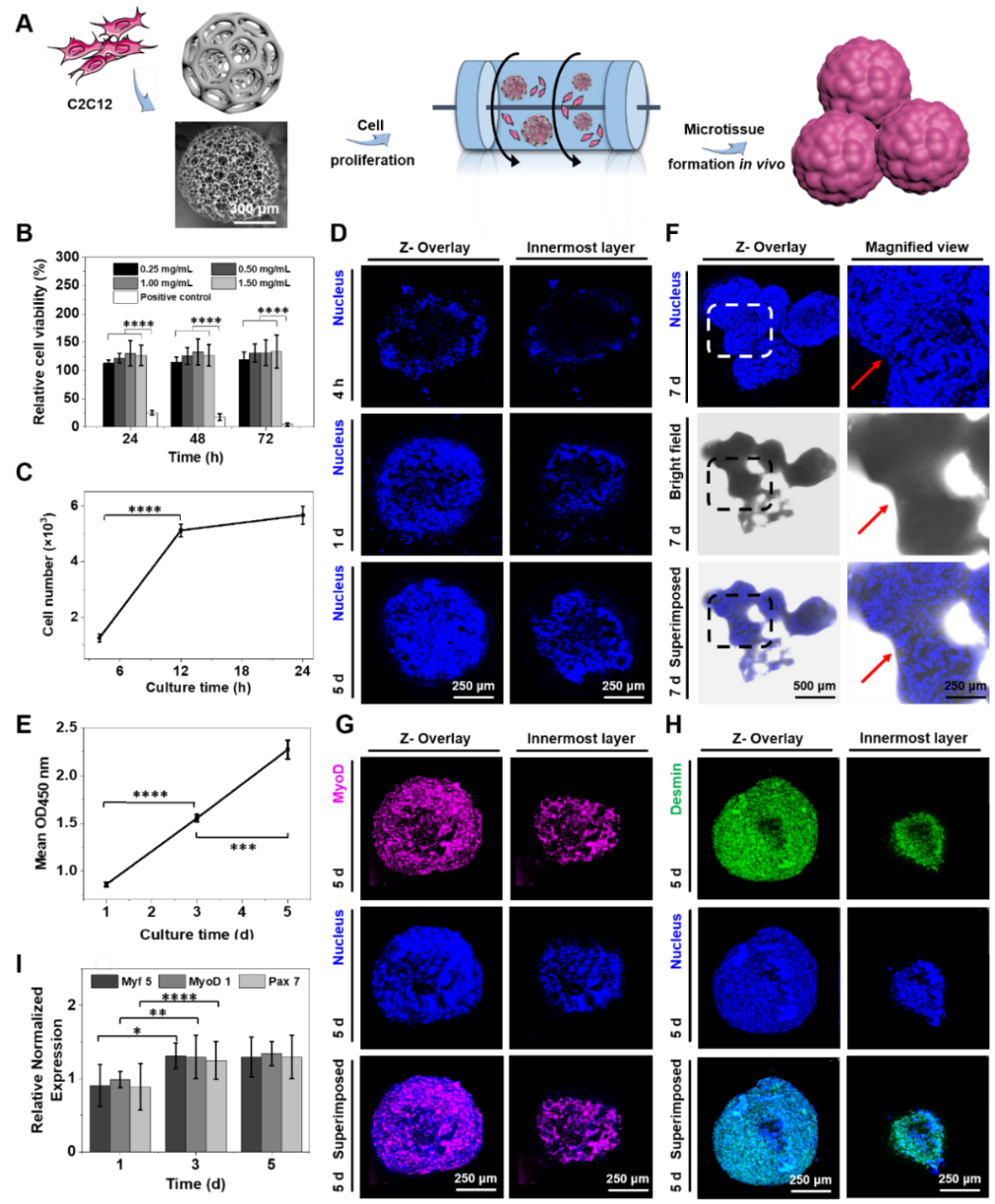
图1. 基于 PLGA PMs 体外构建肌肉微组织
然后,通过微流控技术和光聚合技术相结合得到负载HUVECs的中空短棒状血管微组织。以丙烯酸-聚乙二醇-琥珀酰亚胺基羧甲基酯(Acr-PEG-NHS)为原料,以共价修饰的方法得到了细胞活性好的精氨酸-甘氨酸-天冬氨酸-PEG-Acr(RGD-PEG-Acr)及血管内皮生长因子-PEG-Acr(VEGF-PEG-Acr),并研究了修饰作用下材料的生物安全性及对HUVECs生长的调控作用。另外,采用复乳法制备载碱性成纤维细胞生长因子(bFGF)的PLGA纳米粒(NPs),并复合到PEG水凝胶网络中(图2)。利用微流控技术结合UV引发光聚合技术制备了中空短棒状微纤维,微纤维外径约为350 μm、内径约为110 μm、厚度约为120 μm、长度约为1.5 mm,DAPI染色结果表明体外培养5天后,支架仍具有良好的中空结构及机械强度,HUVECs呈管状分布;且实时定量聚合酶链式反应(qRT-PCR)方法分析结果显示促血管生成素(Ang-2)、基质金属蛋白酶-2(MMP-2)和酪氨酸激酶-2(Tie-2)中特定信号传导部分的表达水平均有显著性提升,表明了体外血管形成的趋势。
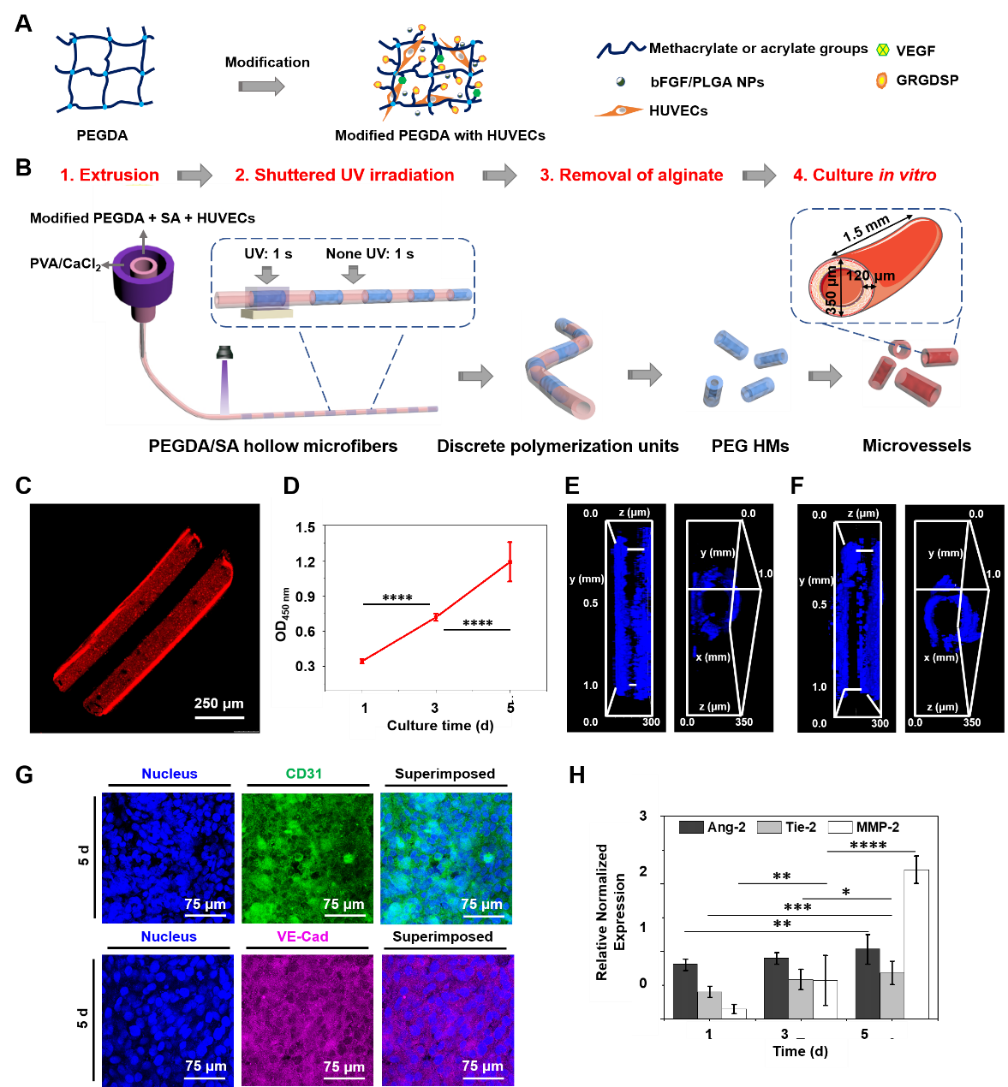
图2. 基于 PEG HMs 体外构建血管微组织
最后,为了进一步研究共混后的肌肉微组织及血管微组织在体内的作用情况,在已经形成的肌缺损部位注射入混合肌肉微组织、血管微组织作为实验组,同时分别注射生理盐水、乙醇、空白支架、混合细胞悬液为对照组,以造模后不处理作为空白对照组,观察重度联合免疫缺陷(SCID)小鼠大体积肌缺损的肌肉修复和组织再生情况(图3)。通过苏木素-伊红(HE)染色观察注射后组织的水肿、纤维化、及肌细胞再生的情况。根据HE结果分析可以看出术后3d内属肌组织的破坏、炎症阶段,3d-14d为肌组织修复阶段,注射入机体的PLGA PMs由于含有大量成熟的C2C12细胞,且体外实验证明,在动态培养下C2C12-PLGA PMs能够出现自由聚集,这些聚集有助于微载体中的C2C12细胞根据机体需要和自身的成肌细胞组装形成中心排列的核进而形成肌纤维。14d-28d为肌组织重塑阶段,对于实验组来说,成纤维细胞的增生为合成结缔组织、为再生组织提供稳定的微环境起到重要作用,肌组织的修复基本完成。
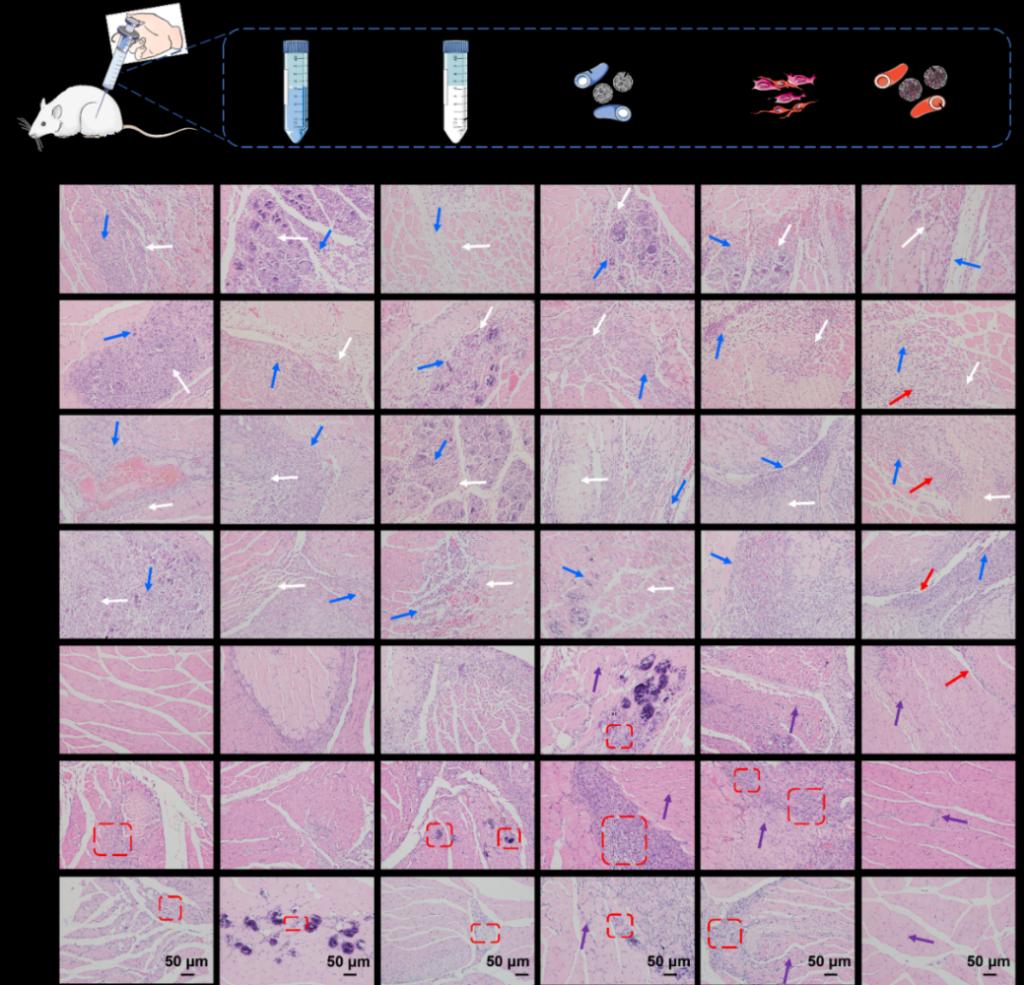
图3. SCID 小鼠右后腿胫前肌注射、肌肉微组织+血管微组织、乙醇、空白微球、生理盐水、细胞混悬液及空白对照组不同时间后HE染色分析
研究结果表明,基于微流体控技术制备的大多孔微球、中空短棒装微纤维作为微载体在构建血管化组织用于组织再生的研究具有潜在的应用前景。